Mengapa ada hukum termodinamika 1 dan 2?
Seringkali kita bertanya mengapa di dalam konsep termodinamika ada hukum 1 thermodinamika dan hukum 2 thermodinamika. Mengapa tidak salah satu saja? Apa hubungannya kedua hukum tersebut?
Hukum 1 termodinamika membicarakan perubahan energi, kerja dan kalor. Dapat dituliskan dalam persamaan keseimbangan energi berikut, \begin{equation}E_1 - E_2 = Q - W, \end{equation} di mana  adalah energi akhir sistem,
adalah energi akhir sistem,  adalah energi awal sistem,
adalah energi awal sistem,  adalah kalor yang masuk sistem,
adalah kalor yang masuk sistem, 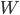 adalah kalor yang keluar sistem. Ruas kiri persamaan (1) dapat dijabarkan lebih lanjut menjadi persamaan berikut, \begin{equation} E_2 - E_1 = (KE_2 - KE_1) + (PE_2 - PE_1) + (U_2 - U_1). \end{equation}
adalah kalor yang keluar sistem. Ruas kiri persamaan (1) dapat dijabarkan lebih lanjut menjadi persamaan berikut, \begin{equation} E_2 - E_1 = (KE_2 - KE_1) + (PE_2 - PE_1) + (U_2 - U_1). \end{equation} 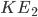 adalah energi kinetik akhir sistem,
adalah energi kinetik akhir sistem,  adalah energi kinetik awal sistem,
adalah energi kinetik awal sistem,  adalah energi potensial akhir sistem,
adalah energi potensial akhir sistem, 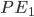 adalah energi potensial awal sistem,
adalah energi potensial awal sistem, 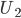 adalah energi-dalam akhir sistem dan
adalah energi-dalam akhir sistem dan  adalah energi-dalam awal sistem. Jika diasumsikan tidak ada perubahan energi dalam dan perubahan energi awal dan akhir sistem, persamaan (2) sering kita sebut dengan hukum kekekalan energi. Baik persamaan (1) maupun (2) menunjukkan bahwa secara matematis kita bisa memasukkan nilai masing-masing komponen. Pemasukan angka tersebut bisa semau kita, seperti pada tabel di bawah ini,
adalah energi-dalam awal sistem. Jika diasumsikan tidak ada perubahan energi dalam dan perubahan energi awal dan akhir sistem, persamaan (2) sering kita sebut dengan hukum kekekalan energi. Baik persamaan (1) maupun (2) menunjukkan bahwa secara matematis kita bisa memasukkan nilai masing-masing komponen. Pemasukan angka tersebut bisa semau kita, seperti pada tabel di bawah ini,
-
Proses

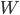




60
-30
70
20

30
10
30

-20
50
70
30
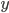
-
-70
40
0

60
30
-
-100
Secara matematis dengan persamaan (1), pada proses
 , dapat diperoleh nilai
, dapat diperoleh nilai  sebesar -70 J dan
sebesar -70 J dan  sebesar 90 J. Begitu pula nilai-nilai pada sel-sel yang diberi warna merah pada proses lainnya dapat diketahui dengan pesamaan (1). Akan tetapi, seringkali hitungan matematis memiliki batasan yakni pada ada atau tidaknya proses fisis tesebut di dunia nyata. Hal ini yang membatasi penggunaan hukum 1 termodinamika. Secara persamaan hukum 1 bisa dipecahkan tetapi tidak ada alat/fenomenanya di dunia nyata.
sebesar 90 J. Begitu pula nilai-nilai pada sel-sel yang diberi warna merah pada proses lainnya dapat diketahui dengan pesamaan (1). Akan tetapi, seringkali hitungan matematis memiliki batasan yakni pada ada atau tidaknya proses fisis tesebut di dunia nyata. Hal ini yang membatasi penggunaan hukum 1 termodinamika. Secara persamaan hukum 1 bisa dipecahkan tetapi tidak ada alat/fenomenanya di dunia nyata.
Dikarenakan kendala tersebut diperlukan Hukum 2 termodinamika untuk menjawab kendala yang dihadapi oleh hukum 1 termodinamika. Terdapat dua pernyataan dalam hukum 2 termodinamika. Pernyataan pertama adalah pernyataan Clausius yaitu “tidak mungkin bagi sebuah sistem beroperasi sedemikian rupa sehingga hasil satu-satunya dari sistem tersebut adalah transfer energi oleh kalor dari reservoar dingin ke reservoar yang lebih panas”. Pernyataan Clausius ini menunjukkan bahwa tidak ada perpindahan panas dari temperatur rendah (dingin) ke temperatur tinggi (panas) secara spontan. Sedangkan pernyataan kedua adalah pernyataan Kelvin-Planck bahwa “tidak mungkin bagi sebuah sistem yang beroperasi dalam siklus termodinamika menghasilkan kerja netto ke lingkungan sambil menerima panas dari satu reservoir thermal semata”. Pernyataan ini menunjukkan bahwa tidak semua energi yang masuk ke dalam sebuah sistem berubah 100% menjadi kerja. Selain itu, dalam hukum 2 termodinamika terdapat kosep entropi yang memberikan batasan bahwa entropi sistem memiliki kecenderungan untuk meningkat. Entropi dapat diinterpretasikan sebagai tingkat ketidak teraturan sebuah sistem. Kinerja dari sebuah mesin dapat mengalami penurunan akibat adanya entropi. Sumber utama entropi adalah gesekan.
Jadi, jelas bahwa penggunaan hukum 1 termodinamika saja tidaklah cukup dalam mengamati fenomena termodinamika. Dibutuhkan hukum 2 termodinamika yang menjabarkan apakah proses tersebut ada di dunia ini atau hanya imajinasi saja.




